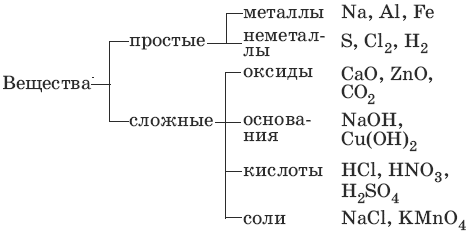
ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКОЙ ХИМИИ.
ОКСИДЫ.
Оксиды – сложные вещества, состоящие из атомов кислорода в степени окисления -2 и атомов другого элемента.
Номенклатура: Fe2O3 – оксид железа(III), Cl2O – оксид хлора(I).
Классификация оксидов Несолеобразующие (безразличные) оксиды: CO, SiO, NO, N2O.
Солеобразующие оксиды:
основные – оксиды металлов в степени окисления +1, +2,
амфотерные – оксиды металлов в степени окисления +2, +3, +4,
кислотные – оксиды металлов в степени окисления +5, +6, +7 и
оксиды неметаллов в степени окисления +1 – +7.
Получение оксидов Горение простых веществ:
С + O2 = CO2
2Са + O2 = 2СаО
Горение (обжиг) сложных веществ:
CH4 + 2O2 = CO2 + 2Н2O
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
Разложение сложных веществ:
CaCO3 >t> СаО + CO2
2Fe(OH)3 >t> Fe2O3 + ЗН2O
Химические свойства оксидов Основным оксидам (Na2O, CaO, CuO, FeO) соответствуют основания.
СаО + Н2O = Са(OH)2 (растворимы оксиды металлов IA– и IIА-групп, кроме Be, Mg)
CuO + Н2O ? (оксиды остальных металлов нерастворимы)
СаО + CO2 = CaCO3
СаО + 2HCl = CaCl2 + Н2O
Кислотным оксидам (CO2, Р2O5, СrO3, Mn2O7) соответствуют кислоты.
SO2 + Н2O = H2SO3 (кислотные оксиды, кроме SiO2, растворимы в воде)
SO2 + СаО = CaSO3
SO2 + 2NaOH = Na2SO3 + Н2O
Амфотерным оксидам (ZnO, Al2O3, Cr2O3, ВеО, РЬО) соответствуют амфотерные гидроксиды.
ZnO + H2O ? (амфотерные оксиды нерастворимы в воде)
ZnO + 2HCl = ZnCl2 + Н2O
ZnO + 2NaOH >t> Na2ZnO2 + Н2O (при нагревании или сплавлении)
ZnO + 2NaOH + H2O = Na2[Zn(OH)4] (в разбавленном растворе).
ОСНОВАНИЯ.
Номенклатура: Fe(OH)3 – гидроксид железа(III).
Классификация оснований: – растворимые (щелочи) NaOH, KOH;
– нерастворимые Fe(OH)2, Mg(OH)2;
– амфотерные Zn(OH)2, Al(OH)3, Ве(OH)2, Сr(OH)3;
– однокислотные NaOH, KOH;
– двухкислотные Ва(OH)2, Zn(OH)2;
– трехкислотные Al(OH)3, Сr(OH)3.
Получение оснований Получение щелочей:
2Na + 2Н2O = 2NaOH + Н2
Na2O + Н2O = 2NaOH
Получение нерастворимых и амфотер-ных оснований:
FeSO4 + 2NaOH = Fe(OH)2v + Na2SO4
AlCl3 + 3NaOH = Al(OH)3v + 3NaCl
Свойства щелочей: NaOH > Na+ + OH? (? = 1, фенолфталеин – красный)
NaOH + HCl = NaCl + H2O (реакция нейтрализации)
2NaOH + CO2 = Na2CO3 + H2O
2NaOH + Zn(OH)2 = Na2[Zn(OH)4]
2NaOH + Al2O3 >t> 2NaAlO2 + H2O
2NaOH + CuSO4 = Cu(OH)2v + Na2SO4
2NaOH + Zn + 2H2O = Na2[Zn(OH)4] + H2
2NaOH + 2Al + 6H2O = 2Na[Al(OH)4] + 3H2
2NaOH + Si + H2O = Na2SiO3 + 2H2
Свойства нерастворимых оснований: Fe(OH)2 - FeOH+ + OH? (? << 1);
FeOH+ - Fe2+ + OH? (? << 1)
Fe(OH)2 + H2SO4 = FeSO4 + 2H2O
Fe(OH)2 >t> FeO + H2O
Свойства амфотерных оснований: Al3++ ЗOH? + Н2O - Al(OH)3v + Н2O - [Al(OH)4]? + Н+
Al(OH)3 + ЗHCl = AlCl3 + ЗН2O
Al(OH)3 + NaOH = Na[Al(OH)4]
2Al(OH)3 >t> Al2O3 + ЗН2O
КИСЛОТЫ.
Кислоты – сложные вещества, состоящие из атомов водорода и кислотного остатка; кислоты – электролиты, образующие при диссоциации в качестве катионов только катионы водорода.Номенклатура кислот и кислотных остатков:
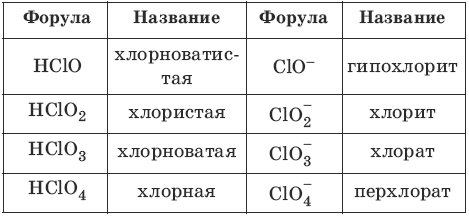
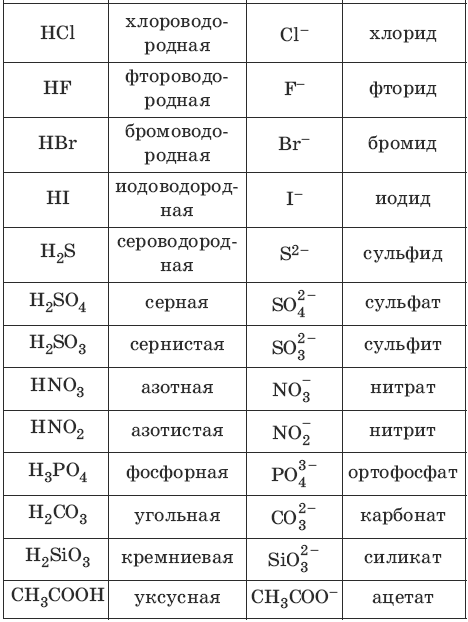 Классификация кислот: – одноосновные HCl
Классификация кислот: – одноосновные HCl– двухосновные H2S
– трехосновные Н3PO4
– кислородсодержащие HNO3
– бескислородные HCl
Получение кислот CO2 + Н2O = Н2CO3 (кроме SiO2)
Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3v
H2 + Cl2 = 2HCl
Химические свойства кислот HCl > H+ + CI? (? =1) (лакмус – красный)
CH3COOH - CH3COO? + H+ (? << 1)
Fe + 2HCl = FeCl2 + H2 (металл в ряду напряжений до Н)
Cu + HCl ? (не идет, металл в ряду напряжений после Н)
2HCl + CuO = CuCl2 + Н2O
2HCl + Cu(OH)2 = CuCl2 + 2Н2O
2HCl + ZnO = ZnCl2 + Н2O
3HCl + Al(OH)3 = AlCl3 + 3Н2O
2HCl + Na2CO3 = 2NaCl + H2O + CO2^ (выделяется газ)
HCl + AgNO3 = AgClv + HNO3 (образуется осадок)
СОЛИ.
Соли – сложные вещества, состоящие из атомов металла и кислотного остатка.Соли – электролиты, образующие при диссоциации катионы металла или аммония и анионы кислотного остатка.
Номенклатура солей Na2HPO4 – гидрофосфат натрия
Са(Н2PO4)2 – дигидрофосфат кальция
AlOHSO4 – гидроксид сульфат алюминия
KMgF3 – фторид калия магния
NaCl • NaF – фторид хлорид натрия
NaNH4HPO4 – гидрофосфат аммония натрия
Na2[Zn(OH)4] – тетрагидроксоцинкат натрия
Классификация солей – средние – MgCl2, Na3PO4
– кислые – Na2HPO4, Ca(H2PO4)2
– основные – MgOHCl, (Al(OH)2)2SO4
– смешанные – NaCl • NaF, CaBrCl
– двойные – KMgF3, KAl(SO4)2
– комплексные – Na2[Zn(OH)4], K3[Cr(OH)6]
– кристаллогидраты – CuSO4 • 5H2O
Получение солей (на примере получения CuS04) Cu + 2H2SO4 конц = CuSO4 + SO2 + 2H2O
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
CuO + H2SO4 = CuSO4 + H2O
CuO + SO3 = CuSO4
Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
CuCO3 + H2SO4 = CuSO4 + H2O + CO2
CuCl2 + Ag2SO4 = CuSO4 + 2AgClv
Химические свойства солей NaHCO3 > Na+ + HCO3? (? = 1)
HCO3? - H+ + CO32- (? << 1)
MgOHCl > MgOH+ + CI? (? = 1)
MgOH+ - Mg2+ + OH? (? << 1)
NaHSO4 > Na+ + Н+ + SO4? (? = 1)
CuSO4 + Fe = Cu + FeSO4 (Fe до Cu в ряду напряжений)
Pb + ZnCl2 ? (Pb после Zn в ряду напряжений)
CuSO4 + 2NaOH = Cu(OH)2v + Na2SO4 (осадок)
CuSO4 + H2S = CuSv + H2SO4 (осадок)
CuSO4 + BaCl2 = BaSO4v + CuCl2 (осадок)
Разложение некоторых солей при нагревании Ca(HCO3)2 >t> CaCO3v + H2O + CO2 (при кипячении воды)
CaCO3 >t> CaO + CO2 (роме устойчивых карбонатов щелочных металлов)
2NaNO3 >t> 2NaNO2 + O2 (металл до Mg в ряду напряжений)
2Pb(NO3)2 >t> 2РbO + 4NO2 + O2 (металл от Mg до Cu в ряду напряжений)
2AgNO3 >t> 2Ag + 2NO2 + O2 (металл после Cu в ряду напряжений)
NH4Cl >t> NH3 + HCl (при охлаждении идет в противоположном направлении)
NH4NO3 >t> N2O + 2Н2O (получение «веселящего» газа)
NH4NO2 >t> N2 + 2H2O (получение азота в лаборатории)
(NH4)2Cr2O7 >t> N2 + Cr2O3 + 4Н2O (реакция «вулкан»)
4KClO3 >400 °C> KCl + 3KClO4
2KClO3 >t, MnO4> 2KCl + 3O2
2КMnO4 >t> К2MnO4 + MnO2 + O2
Связь между классами соединений Металл - основный оксид - основание - соль
Неметалл - кислотный оксид - кислота - соль
Получение и химические свойства щелочных металлов
Получение
2NaCl >электролиз расплава> 2Na + Cl2
KCl + Na >800?С> К + NaCl
Горение в кислороде
4Li + O2 >t> 2Li2O
2Na + O2 >t> Na2O2
К + O2 >t> KO2
Реакции с другими неметаллами
2Na + Cl2 = 2NaCl
2Na + H2 >t> 2NaH
2К + S = K2S
6Li + N2 = 2Li3N
Реакции с водой и разбавленными кислотами
2Na + 2Н2O = 2NaOH + H2^
2Na + 2HCl = 2NaCl + H2^
Кислород и его соединения
Кислород – самый распространенный элемент земной коры. Кислород представляет собой газ без цвета, без вкуса, без запаха. Возможные степени окисления кислорода, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице.
 Получение и свойства кислорода
Получение и свойства кислородаКислород может быть получен при сжижении и разделении воздуха.
2КMnO4 >t> К2MnO4 + MnO2 + O2
2KClO3 >t> 2KCl + 3O2
(NaOH) + 2Н2O >электролиз раствора> 2Н2 + O2
O2 + 2F2 = OF2
2Са + O2 = 2СаО
S + O2 = SO2
2С2Н2 + 5O2 = 4CO2 + 2Н2O
4FeS2 + 11O2 >t> 2Fe2O3 + 8SO2
4NH3 + 3O2 = 6Н2O + 2N2
4NH3 + 5O2 >p, t, Pt> 4NO + 6Н2O
Получение и свойства озона O3
3O2 >hv> 2O3
O3 = O2 + О
KI + Н2O + O3 = I2 + 2KOH + O2
Свойства пероксида водорода
ВaO2 + H2SO4 = BaSO4v + Н2O2 (на холоду)
2Н2O2 >MnO2> 2Н2O + O2
2KMnO4 + 3H2SO4 + 5Н2O2 = 5O2 + 2MnSO4 + K2SO4 + 8H2O
2KI + H2SO4 + H2O2 = I2 + K2SO4 + 2Н2O
Н2O2 + O3 = 2O2 + Н2O
Водород и его соединения
Водород – наиболее распространенный элемент во Вселенной. Водород – легкий газ без цвета, без запаха. Возможные степени окисления водорода, электронные формулы соответствующих ионов, химические свойства и примеры соединений приведены в таблице.
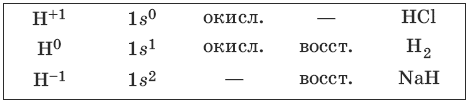 CH4 + 2Н2O >t, катализатор> 4Н2 + CO2
CH4 + 2Н2O >t, катализатор> 4Н2 + CO2Zn + 2HCl = ZnCl2 + Н2
(NaOH) + 2Н2O >электролиз раствора> 2Н2 + O2
Н2 + 2Na >t> 2NaH
Н2 + Са >t> СаН2
2Н2 + O2 = 2Н2O
Н2 + Cl2 >hv> 2HCl
ЗН2 + N2 >t, p, катализатор> 2NH3
NaH + Н2O = NaOH + Н2
СаН2 + 2HCl = CaCl2 + 2Н2
Вода
Молекулы воды связаны водородными связями: nH2O = (Н2O)n, поэтому вода жидкая в отличии от ее газообразных аналогов H2S, H2Se и Н2Те.
Кислород в молекуле воды находится в состоянии sp3-гибридизации, две связи О—Н и две неподеленные пары кислорода располагаются тетраэдрически, угол между связями О—Н равен 104,5°, поэтому молекула воды полярная. Вода является хорошим растворителем для веществ с ионными или полярными связями.
2Na + 2Н2O = 2NaOH + Н2
Fe + 4Н2O >t> Fe3O4 + 4Н2
Ag + Н2O ?
Н2O + СаО = Са(OH)2
Н2O + Al2O3 ?
N2O3 + Н2O = 2HNO2
2CuSO4 + 2Н2O - (CuOH)2SO4 + H2SO4
H2SO4(конц.) + H2O = H2SO4 • H2O
CuSO4 + 5H2O = CuSO4 • 5H2O
Комментариев нет:
Отправить комментарий